- 翰林提供學術活動、國際課程、科研項目一站式留學背景提升服務!
- 400 888 0080
A-Level化學課程知識點講解:buffer solution緩沖溶液
今天給大家梳理一下A-Level/IB/AP化學中的一個重要知識點:buffer solution,緩沖溶液。
化學實驗很多都需要在水溶液環境中進行,并且會需要一個pH較為穩定的水溶液環境。而在大部分溶液中,當加入強酸或強堿時,即使加入的體積很小,也會引起pH的劇變,進而影響實驗效果。因此我們需要配置一個pH可以維持相對穩定的溶液,在加入少量強酸或強堿時也不會引起pH急劇變化,這就是緩沖溶液。
1?緩沖溶液(buffer solution)的定義和成分
就像上面說的,緩沖溶液(buffer solution)指的就是當少量強酸或強堿加入溶液中時,能夠將pH變化最小化,使溶液pH變化相對恒定,“幾乎”不變的溶液。緩沖溶液一般由弱酸及其共軛堿(weak acid and its conjugate base),和弱堿及其共軛酸(weak base and its conjugate acid)混合組成。
舉個例子,醋酸(CH3COOH)和醋酸鈉(CH3COONa)的混合溶液就是一種緩沖溶液。在這個混合溶液中,弱酸是一種弱電解質,部分電離,而醋酸鈉是一種強電解質,也就是發生完全電離。電離反應式如下:
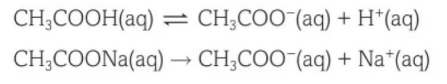
醋酸和醋酸鈉的混合溶液pH低于7,具體pH需要根據醋酸和醋酸鈉分別的濃度,和兩種溶液的體積進行具體計算。
2?緩沖溶液(buffer solution)的pH計算
我們來計算一下剛才講的例子,醋酸和醋酸鈉的pH計算。假設我們將以下醋酸(CH3COOH)和醋酸鈉(CH3COONa)混合:
CH3COOH 1 mol dm-3?50mL
CH3COONa 1 mol dm-3?50mL
首先分析醋酸(CH3COOH),由于醋酸是一種弱酸,只發生部分解離(partially dissociation),且弱酸電離常數Ka=1.74*10-5 mol dm-3,由Ka對應的計算公式可以得知,醋酸(CH3COOH)是一種解離程度很低的弱酸,為了便于計算,我們忽略醋酸(CH3COOH)的解離,近似認為醋酸不發生解離。
再來分析醋酸鈉(CH3COONa),醋酸鈉(CH3COONa)是一種可溶性鹽,可溶性鹽都是強電解質,也就是溶于水的部分會發生完全電離(completely ionised),即醋酸鈉(CH3COONa)完全電離為醋酸根離子(CH3COO-)和鈉離子(Na+)。
當醋酸(CH3COOH)和醋酸鈉(CH3COONa)混合后,由于總溶液體積變為100mL,相當于原來每種溶液濃度的2倍,而這兩種溶液中溶質的摩爾數都沒有變,根據c=n/V可以算出,混合溶液中醋酸(CH3COOH)和醋酸鈉(CH3COONa)的濃度都變為原來的1/2,即0.5 mol dm-3。
在此時的混合溶液中,[CH3COOH]=0.5 mol dm-3,[CH3COO-]=[Na+]0.5 mol dm-3。接下來再將這些數據代入Ka進行計算。
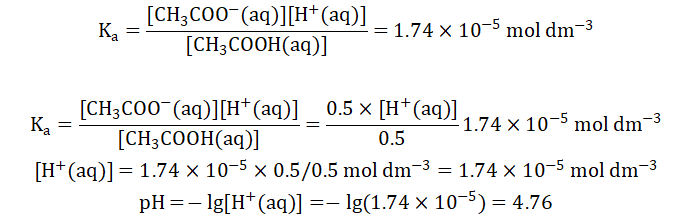
也就是說,濃度分別為1 mol dm-3 ,體積為50mL的醋酸(CH3COOH)和醋酸鈉(CH3COONa)溶液的混合溶液pH為4.76。我們再將這一算法推廣到所有由弱酸及其共軛堿組成的緩沖溶液。
對于一種弱酸HA,其濃度一般被表示為[HA(aq)],它對應的共軛堿為A-,濃度表示為[A-(aq)],弱酸解離常數表示為Ka。同樣,我們認為HA這種弱酸幾乎不發生解離,A-對應的鹽完全解離,那么,Ka的式子可以表示為:
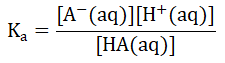
我們把[H+(aq)]提出來,將式子變為![]() 兩邊同時取-lg,式子變為
兩邊同時取-lg,式子變為![]() 即
即![]() 。這個公式被稱為Henderson-Hasselbalch公式,其中,[HA]為緩沖溶液中弱酸的濃度,[A-]為緩沖溶液中弱酸的共軛堿的濃度。
。這個公式被稱為Henderson-Hasselbalch公式,其中,[HA]為緩沖溶液中弱酸的濃度,[A-]為緩沖溶液中弱酸的共軛堿的濃度。
3?向緩沖溶液中加入酸堿后pH變化
現在我們來驗證一下在向剛才計算出pH為4.76的緩沖溶液中分別加入10 mL 1 mol dm-3 HCl(aq),和10 mL 1 mol dm-3 NaOH給溶液pH會帶來怎樣的變化。我們先來回顧一下剛才提到的醋酸/醋酸根離子緩沖溶液的濃度和體積。
CH3COOH 1 mol dm-3 50mL
CH3COONa 1 mol dm-3?50mL
由此可以算出
n(CH3COOH) = 1 x 0.05 = 0.05 mol
n(CH3COO-) = 1 x 0.05 = 0.05 mol
1. 向溶液中加入10 mL 1 mol dm-3 HCl(aq)
此時加入的n(HCl) = 1 x 0.01 = 0.01 mol
HCl會和緩沖溶液中的CH3COO-以1:1的摩爾比進行反應,并生成相同摩爾數的CH3COOH,即在加入HCl后
n(CH3COO-) = 0.05 - 0.01 = 0.04 mol
n(CH3COOH) = 0.05 + 0.01 = 0.06 mol
此時的pH可以直接用Henderson-Hasselbalch公式進行計算,由于醋酸的電離常數Ka=1.74*10-5 mol dm-3。可以看出,pH變化是較小的,溶液pH在一個較為穩定的狀態。
2. 向溶液中加入10 mL 1 mol dm-3 NaOH(aq)
此時加入的n(NaOH) = 1 x 0.01 = 0.01 mol
NaOH會和緩沖溶液中的CH3COOH以1:1的摩爾比進行反應,并生成相同摩爾數的CH3COO-,即在加入NaOH后
n(CH3COOH) = 0.05 - 0.01 = 0.04 mol
n(CH3COO-) = 0.05 + 0.01 = 0.06 mol
此時的pH可以直接用Henderson-Hasselbalch公式進行計算,由于醋酸的電離常數Ka=1.74*10-5 mol dm-3與加入HCl時一樣,溶液pH變化較小在一個較為穩定的狀態。
4?總結
緩沖溶液(buffer solution)的練習中比較容易出錯的點是:
1.?將緩沖溶液當做弱酸進行計算,認為酸根離子和氫離子濃度一樣
2. 在兩種溶液混合后,忘記體積變化帶來的每種溶質濃度變化。
緩沖溶液的題目涉及的計算量相對別的內容比較大,想要這部分不出錯的話還是要多做歷年真題多進行一些真題的計算練習。
掃碼添加翰林顧問老師,可一對一制定國際課程規劃
【免費領取】GCSE/A-Level備考資料合集~


最新發布
? 2025. All Rights Reserved. 滬ICP備2023009024號-1









