- 翰林提供學術活動、國際課程、科研項目一站式留學背景提升服務!
- 400 888 0080
A-Level化學課程知識點講解:Mass spectrometry質譜分析法
大家都知道化學是一門以實驗為基礎的學科,今天就以A-Level化學課程知識點:‘’Mass spectrometry質譜分析法‘’為例,來講一講儀器分析方法是如何做到將抽象的名詞具象化,來幫助我們理解和掌握這些概念的。
Mass spectrometry在AS的Topic 2-2A當中首次出現。在這一章之前,我們介紹了相對原子質量(relative atomic mass)與相對同位素質量(relative isotopic mass)的區別。正是因為大多數元素都擁有不止一種同位素(isotope),才使得同一種物質的微粒可能由質量上有些微差別的同位素原子組成,具有不同的相對式量(relative formula mass)。但是也由于各種同位素原子在自然環境中的含量占比,即豐度(abundance)是相對恒定的,所以這些物質的相對式量得以用一個均值來表示。
質譜分析法是一種非常重要的儀器分析手段,采用質譜儀(mass spectrometer)測量原子與分子質量,也可以用來辨別不同的同位素。質譜儀的內部結構如下圖所示:
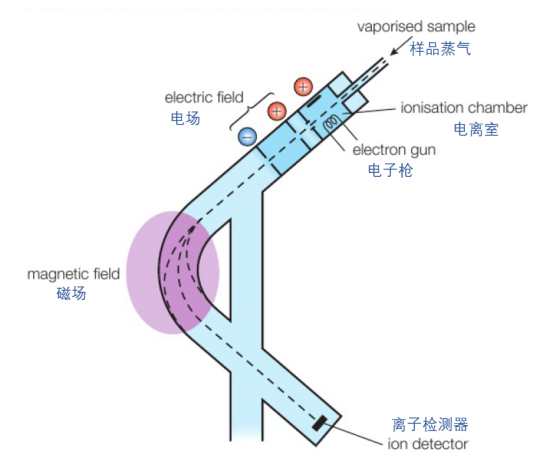
它的工作流程可以視為:
①電離(ionisation):首先,需要將待測樣以氣態形式(gaseous state)注入質譜儀。接下來,樣品蒸氣在高能電子的轟擊下,一些電子會受到撞擊而脫離,形成帶正電荷的微粒(positive ions)。
②加速(acceleration):?帶正電的微粒經過一段電場,將會被加速。
③偏轉(deflection):?再經過一段磁場后,微粒的運行軌跡會因為各自的質荷比(mass-to-charge, m/z)不同而發生不同程度的偏轉。質荷比越大,偏轉程度越小。
④檢測(detection):偏轉后的粒子將通過一個狹縫,落在一個與放大器連接的金屬平面上被收集檢測。通過產生的電流大小,反映出收集到的微粒所占比重。
⑤分析(analysis):由于磁場的強度可以調節,我們將收集到不同質荷比的粒子,最后將得到的數據繪制成圖像,來分析樣品的組成與質量。
接下來,我們以氯氣進樣微粒來看一下圖像如何分析:
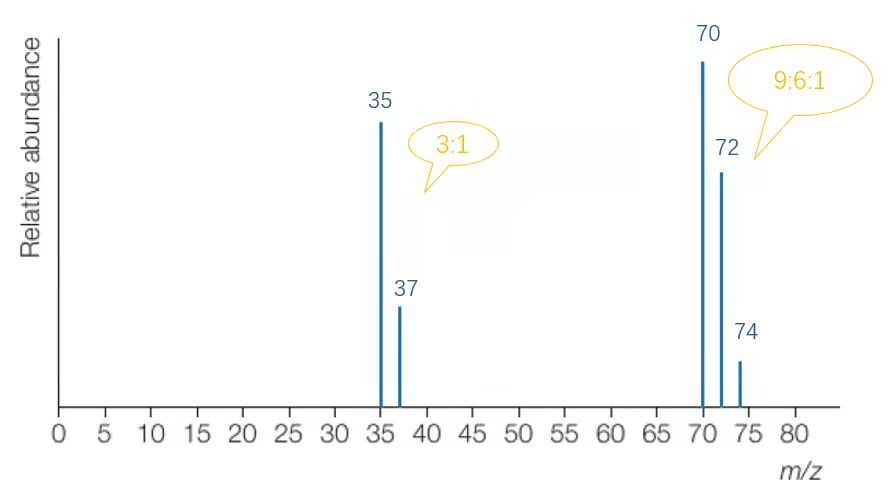
在將相對式量保留到整數位后,可以得到上圖。
橫坐標為質荷比(m/z),在假定電荷數z=1的狀況下,橫坐標可以視為相對質量;而峰(peak)的高度表示了該粒子的占比,對于原子來說,也即豐度。結合已有的同位素知識,我們知道氯原子有Cl-35與Cl-37兩種同位素,其相對含量的比值約為3:1,恰與此圖相符。質譜分析法的圖像將這一抽象概念直觀地展示了出來。
假設共有100個氯原子,則根據Cl-35與Cl-37的豐度約為3/4和1/4,其中的Cl-35原子有75個,Cl-37原子有25個,所有Cl原子的平均式量為![]() ,正是我們熟悉的標在元素周期表上的Cl的相對同位素質量。
,正是我們熟悉的標在元素周期表上的Cl的相對同位素質量。
而70,72,74這三個峰則代表著三種不同式量的氯氣。

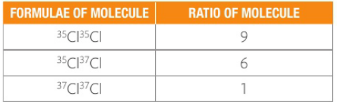
這三種氯氣分子的占比又怎么求呢?由于 Cl-35占3/4,Cl-37占1/4,任取兩個Cl原子組成氯氣分子Cl2,35Cl35Cl的概率為:![]()
35Cl37Cl的概率為:![]() (注意這里×2的原因是同樣要計算37Cl35Cl的概率)
(注意這里×2的原因是同樣要計算37Cl35Cl的概率)
37Cl37Cl的概率為:![]()
所以最后我們得到這三種氯氣的比值是9:6:1,和圖像上標出的各峰高度也能保持基本一致。(由于相對式量不是精確值,故圖上各峰高度之比也不是精確的9:6:1)
而氯氣的平均相對式量不管是由氯原子的relative isotopic mass來算:35.2×2=71,或者是由三種氯氣的組成和質量來算![]() 都能得到相同的答案71。
都能得到相同的答案71。
同學們以后遇到mass spectrometry的問題都可以用類似的模型來解答。
掃碼咨詢,可一對一制定國際課程規劃
【免費領取】GCSE/A-Level備考資料合集,了解課程優惠~


最新發布
? 2025. All Rights Reserved. 滬ICP備2023009024號-1









