- 翰林提供學術活動、國際課程、科研項目一站式留學背景提升服務!
- 400 888 0080
A-Level化學課程:Hess’s Law在計算題中的應用!
在A-Level化學第六章節(jié)初始,我們會接觸到一個概念叫“焓”(Enthalpy),它指的是一份物質所具有的能量,用焓=內能+壓強*體積來表示。然而對于焓的理解是比較抽象的,但理解焓的差值“焓變”就容易多了。
很多化學反應,在反應前后會有溫度變化,例如木炭燃燒、硝酸銨結冰等。這就代表了吸熱或放熱反應中的能量得失。這部分能量我們就稱之為“焓變”。
例如我們在室外燃燒一小塊炭生成CO2放出10kJ熱量,那么這部分能量就用?H來表示,代表燃燒過程中逸散到空氣中的熱量。反應產生的能量變化可以是不同形式的,包括熱量、光、體積變化等等,但這些能量的變化,我們都可以稱之為“焓變”。
焓變也有不同的形式,例如反應焓、形成焓、燃燒焓、中和焓和原子化焓等,這些焓有些是可以實際測量的,也有些是我們?yōu)榱擞嬎愣摌嫷模瑢嶋H反應可能并不存在。那么在引入了焓的概念以及各類焓的定義之后,就來看看他在我們的題目里是怎么應用的吧。在此之前,我們需要理解Hess’s Law是如何運用的。

對于一個化學反應,總能量變化是一定的,無論經過幾步反應,或者經過什么反應路徑,甚至是虛構的中間步驟。類似于物理或者數(shù)學中的向量,無論你經過幾個(連續(xù)的)步驟,只要起點和終點是相同的,向量和也就相同。
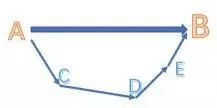 (從圖中就能很直觀的看出)
(從圖中就能很直觀的看出)
下面我們做一道題來嘗試一下吧!(題目如下)

在此題中,我們無法直接求得由C4H10的燃燒焓,那么我們就需要走一個彎路,尋求反應物和生成物之間的一個共同終點站B,也就是C、H2和氧氣分別形成它們的形成焓?fH?。盡管并不可能用碳粉和氫氣氧氣來制成丁烷,但在原子數(shù)上,ABC確實都保持了平衡,那么這個循環(huán)就是成立的。我們來畫出一個焓變示意圖。
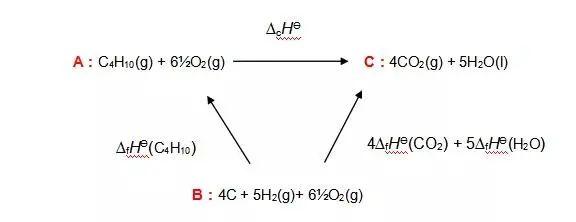
由C、H2、O2形成C4H10的能量是C4H10的形成焓?fH?(C4H10),同時等量的O2可以約去;另一邊,同樣由C、H2、O2形成CO2和H2O的能量是四份?fH?(CO2)和五份?fH?(H2O)。那么,我們求A→C的焓,也就是求A→B→C的總焓。
值得注意的是,這里的?fH?(C4H10)表示的反應方向是C→A,所以我們如果要表示A→B,需要取?fH?(C4H10)的負值,所以?fH?=-?fH?(C4H10)+(4?fH?(CO2)+5?fH?(H2O))=-(-134.5)+(4*-393.5+5*-285.8)=2868.5 KJ mol-1,也就表明丁烷C4H10的燃燒焓為2868.5 KJ mol-1。
這道題算是一種簡單的循環(huán),更復雜的循環(huán)會涉及到多步反應和相變,在同學們刷題過程中,如果遇到也不要害怕。注意反應方向和保持元素平衡,即使是十幾步反應,也能像拼圖一樣一步步完整起來。
需要針對A-level考試輔導提升的同學可以掃碼添加翰林顧問老師咨詢~
還能【免費領取】相關真題及解析!


最新發(fā)布
? 2025. All Rights Reserved. 滬ICP備2023009024號-1









