- 翰林提供學術活動、國際課程、科研項目一站式留學背景提升服務!
- 400 888 0080
化學學習方法從AS到A2如何真正學懂Equilibirum
小提示:本文干貨較多,請耐心并認真閱讀對于Equilibrium的知識相信同學們無論在GCSE 還是在AL階段都有一定程度的了解,并且在我們的印象中這并不是一個特別難懂或者難得分的知識點。
你以為知道Dynamic equilibrium 就夠了?
知道怎么去判斷Equilibrium shift就夠了?
知道如何去求解兩個Equilibrium constant就夠了?
如果你這么想就太天真了!
在階段,你要明白:
Chemical Equilibrium is an Dynamic Equilibrium,相信同學們對于這句話已經耳熟能詳,沒錯,它告訴我們的就是化學平衡是一個動態平衡。
但是大部分同學們只是停留在這句話的背誦上,而沒有真正的考慮它在真正告訴我們什么。
其實對于動態平衡的理解要從這兩個方面出發:
第一,當我們說一個chemical reaction reaches equilibrium的時候,那么作為一個reversible reaction,rate of forward reactionrate of backward reaction。
也就是說,在可逆反應當中,當一個反應達到平衡之后,有多少反應物轉化為生成物就有多少生成物轉化回反應物。
第二,當我們說一個chemical reaction reaches equilibrium的時候,the concentrations of all the substance in the reaction stay the same. 注意,同學們對于這個same的理解有時候會出現偏差。
它指的并不是所有物質的concentration 都相等(equal)!而是在說當反應達到平衡的時候,the concentrations of all the substance in the reaction stay unchanged!
每一個substance 在平衡的時候都有自己的concentration并且這個concentration 保持不變,并不意味著所有的concentrations都相等!敲黑板!以上兩個方面也是考試中Why chemical equilibrium is a dynamic equilibrium 的答案!
Le chatelier’s principle 是幫助我們判斷化學反應平衡移動的重要規則,對于一個已經達到平衡的可以反應,conditions 的改變就會引起化學反應平衡的移動。
能夠引起平衡移動的factors小編相信同學們已經非常熟悉了,它們分別是concentration, pressure(gaseous system),temperature (Endothermic or exothermic), 最后一個就是catalyst。
對于前面幾個,相信同學們已經能夠很好的判斷平衡移動的方向了,在這兒小編要著重給同學們講講最后一個catalyst。
Catalyst并不能夠引起平衡的移動,它只是可以讓一個reaction能夠快速的達到平衡狀態。
當然,我們在學習catalyst的時候就提到過,并不是所有加catalyst的目的都是加速reaction,也有一些reaction 需要減慢速度,只是我們平時不常見而已。
一般在catalyst當中都有一個重要的組成部分,那就是transition metal,如果看到這個詞,同學們腦海中一片空白的話,快去翻翻書,把這部分知識撿起來! 因為按照新的出題的趨勢,各個topic之間的聯系越來越大。
在一道題目中,只要能夠涉及的知識點都非常有可能考到。
在A2階段,這部分知識更是需要我們做更多的了解和學習。
首先就是一個量化的概念:Equilibrium constant
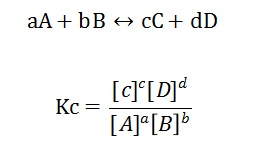
Kc就是這個reversible reaction的Equilibrium constant,[ ]代表這一個substance的concentration, 而a,b,c,d 則是這個reaction的balancing number。
注意!在記憶這個公式的時候一定要把它和rate equation 的計算公式區分開(order of the reaction)。
當然如果我們上面的ABCD都是Gas,那么這個Equilibrium constant也可以用Kp的形式來表達:
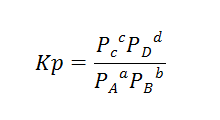
這里面,等等這些參數都是Partial pressure, 他們加起來就應該是整個這個system的total pressure 。
那么這樣的話其實每一個partial pressure就非常好求啦,只需要用他們各自的fractional moles 去乘以total pressure 得到的就是每個substance各自的partial pressure.注意!
重點和易錯的地方又來了,無論是Kc 還是Kp的計算,里面所用的concentration 和 partial pressure都是各個substance 在equilibrium 時候的value.也就是說我們要以計算的value,既不是start of the reaction 時候的,也不是during the reaction 的!在這里再次強調是因為同學們經常會在這里犯錯而導致無謂的丟分。
一般來講,對于一個excess reactant,equilibrium concentration往往是它after reaction 剩下的,而對于product 而言,equilibrium concentration 往往是它after the reaction 生成的。
小編在這兒再次提醒同學們在計算的時候盡量按照標準的三段式進行分析計算,即把start of the reaction, during the reaction 以及 equilibrium 這三個階段的concentration都寫在reaction 下面,然后所有的東西就都一目了然啦!
如果上面三個知識點同學們已經掌握的非常棒了,那我們就來看看最有一個問題,why le chatelier’s principle? ?不知道同學們是否想過,我們可以用le chatelier’s principle 來判斷一個equilibrium 的移動方向,但是為什么可以這樣,有沒有任何的theory可以支持這樣的一個規則呢?
答案當然是肯定的,那就是我們上面講的這個equilibrium constant. 注意,Kc 和Kp只受溫度的影響,那么也就是說在溫度不變的情況下,Kc 和Kp 是不變的!
那這樣的結論為什么能夠支持Le chatelier’s principle? 下面小編就為大家舉個例子,讓大家體驗一下Equilibrium 的神奇。
我們就拿
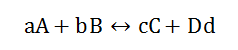
這個reaction來舉例,如果現在Increase the concentration of A, 我們先不著急用Le chatelier’s principle來判斷移動方向,我們先看看Kc 這時候會有什么變化
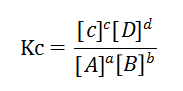
[A]如果突然增加,那么對于Kc來講會馬上decreace,形成一個新的Kc‘<Kc,我們說過當溫度不變時,Kc是不變的,所以Kc’要變回到原來的Kc。
從數學角度來說,Kc’ 可以走的路有兩條:一.讓[B]decrease;二.讓[C] ,[D] increase. 那我們再從chemical reaction 的角度來看看,[B]decrease; [C] ,[D] increase, 是不是剛剛好是讓Equilibrium shifts to right 來實現的呢?
是不是剛剛好obey Le chatelier’s principle 呢?如果同學們有興趣,可以自己去試試別的conditions,屢試不爽。
最后一次敲黑板!在新的出題模式下,這種題目類型是考官特別喜歡的!

最新發布
? 2025. All Rights Reserved. 滬ICP備2023009024號-1









